2019年12月31日,國(guó)家藥品監(jiān)督管理局發(fā)布通告稱��,在對(duì)廣西雙健科技有限公司的飛行檢查中���,發(fā)現(xiàn)該企業(yè)質(zhì)量管理體系存在諸多缺陷�,責(zé)令該企業(yè)立即停產(chǎn)整改����。
引言:2019醫(yī)療器械飛檢| 停產(chǎn)整改15家����,高風(fēng)險(xiǎn)產(chǎn)品仍是重點(diǎn)�。

2019年12月31日,國(guó)家藥品監(jiān)督管理局發(fā)布通告稱����,在對(duì)廣西雙健科技有限公司的飛行檢查中,發(fā)現(xiàn)該企業(yè)質(zhì)量管理體系存在諸多缺陷�����,責(zé)令該企業(yè)立即停產(chǎn)整改��。
近年來(lái)��,在大力深化審評(píng)審批制度改革的同時(shí)����,監(jiān)管部門不斷加大政策合規(guī)管控力度,飛行檢查成為最有力的監(jiān)管手段之一���。2019年12月中旬����,在中國(guó)醫(yī)療器械行業(yè)協(xié)會(huì)2019產(chǎn)業(yè)年會(huì)上,國(guó)家藥監(jiān)局審核查驗(yàn)中心有關(guān)人員對(duì)2019年醫(yī)療器械飛檢情進(jìn)行了分析�。
一、國(guó)家藥監(jiān)總局醫(yī)療器械飛檢不合格者超過五成
監(jiān)管風(fēng)險(xiǎn)和問題導(dǎo)向是醫(yī)療器械飛行檢查的總體原則�,尤其是2019年,國(guó)家藥監(jiān)局在高風(fēng)險(xiǎn)產(chǎn)品監(jiān)管方面有所調(diào)整����。截至2019年12月14日,國(guó)家藥監(jiān)局核查中心共組織40個(gè)檢查組���,選派了122人次檢查員���,對(duì)80家醫(yī)療器械生產(chǎn)企業(yè)進(jìn)行了飛行檢查。其中�,多年或多品種國(guó)抽不合格42家(占比53%),投訴舉報(bào)5家(占比6%)�����,不良事件1家(占比1%)���,合規(guī)檢查32家(占比40%)��。
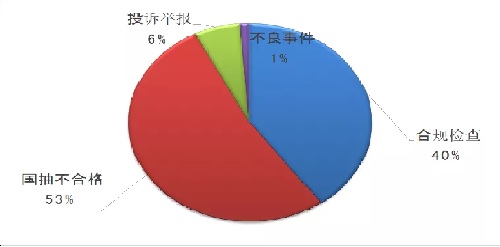
根據(jù)國(guó)抽的數(shù)據(jù)和分析���,在2019年的飛行檢查中,來(lái)自抽樣不合格的占53%��。從國(guó)家監(jiān)管角度來(lái)講��,2019年是改革第一年����,因此把抽樣作為重點(diǎn),2020年可能會(huì)有調(diào)整����。整個(gè)品種的分配,基本還是無(wú)源和植入的高風(fēng)險(xiǎn)產(chǎn)品占主導(dǎo)����,這類品種占比過半。
二�、總局醫(yī)療器械飛檢發(fā)現(xiàn)企業(yè)主體責(zé)任意識(shí)仍待加強(qiáng)
2019年醫(yī)療器械飛檢的結(jié)果如下:立案查處企業(yè)1家;停產(chǎn)整改企業(yè)15家�;限期整改企業(yè)40家;檢查期間�,產(chǎn)品停產(chǎn)整改企業(yè)18家��;注銷產(chǎn)品注冊(cè)證3家�����;注銷生產(chǎn)許可證3家����。其中����,被責(zé)令停產(chǎn)整改的,在國(guó)家藥監(jiān)局官網(wǎng)進(jìn)行公告����;限期整改的,在核查中心網(wǎng)站“醫(yī)療器械檢查專欄”公開�。
檢查結(jié)果。
從癥結(jié)分析方面來(lái)看���,2018年飛行檢查90家����,2019年為80家�,雖然比上年少了一些,但確確實(shí)實(shí)偏重于高風(fēng)險(xiǎn)產(chǎn)品�,包括投訴舉報(bào)、不良事件��、抽樣不合格等等�,其實(shí)代表著企業(yè)或多或少存在各種問題。有些是企業(yè)對(duì)相關(guān)條款不太理解����,而有些則是企業(yè)存有僥幸心理,認(rèn)為抽檢是小概率���,只要沒抽到就不用關(guān)注����。
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》第三條規(guī)定����,企業(yè)應(yīng)當(dāng)按照本規(guī)范的要求,結(jié)合產(chǎn)品特點(diǎn),建立健全與所生產(chǎn)醫(yī)療器械相適應(yīng)的質(zhì)量管理體系�,并保證其有效運(yùn)行。也就是說(shuō)�����,實(shí)施規(guī)范的主體責(zé)任是企業(yè),企業(yè)應(yīng)該增加責(zé)任意識(shí)����、質(zhì)量意識(shí)和風(fēng)險(xiǎn)意識(shí),產(chǎn)品的風(fēng)險(xiǎn)降低了�����,監(jiān)管的風(fēng)險(xiǎn)也就降低了���。在質(zhì)量理念方面���,整個(gè)產(chǎn)品生命周期都要圍繞風(fēng)險(xiǎn)管理,包括怎么正確理解《規(guī)范》����,對(duì)于規(guī)范的嚴(yán)格要求怎么靈活把握,靈活性�、具體方法和操作措施有N多個(gè),可以根據(jù)自己產(chǎn)品的實(shí)際情況和本身的能力��,在原則性要求下靈活處理���,以達(dá)到醫(yī)療器械產(chǎn)品安全����、有效�����、合規(guī)的目的��。
關(guān)于質(zhì)量評(píng)審�����,《醫(yī)療器械監(jiān)督管理?xiàng)l例》特別明確��,醫(yī)療器械生產(chǎn)企業(yè)應(yīng)當(dāng)定期對(duì)質(zhì)量管理體系的運(yùn)行情況進(jìn)行自查��,并向所在地省�����、自治區(qū)��、直轄市人民政府食品藥品監(jiān)督管理部門提交自查報(bào)告�。內(nèi)審相當(dāng)于一個(gè)診斷或者健康體檢的措施,每年做一次,實(shí)際上過程中不同模塊都可以做��,包括持續(xù)改進(jìn)����,它能促進(jìn)企業(yè)生產(chǎn)質(zhì)量管理體系的不斷完善,企業(yè)應(yīng)該重視起來(lái)���。