引言:盡管歐盟醫(yī)療器械新法規(guī)MDR推遲一年實施,我們?nèi)匀挥斜匾私庖幌?a title="醫(yī)療器械CE認證" href="http://www.embedupdate.com/service_show.aspx?id=6" target="_blank">醫(yī)療器械CE認證對MDR技術(shù)文檔要求��。

辦理醫(yī)療器械CE符合性聲明和醫(yī)療器械CE認證時���,CE技術(shù)文檔都是必備。CE MDR附錄2將技術(shù)文件分成了6大塊���,并要求技術(shù)文件和相關(guān)總結(jié)應(yīng)該以一種清晰的�����、有組織的���、可檢索的且非模棱兩可的形式呈現(xiàn),同時應(yīng)包含附件2中涉及的內(nèi)容��。見下面圖片�����,供大家參考����。
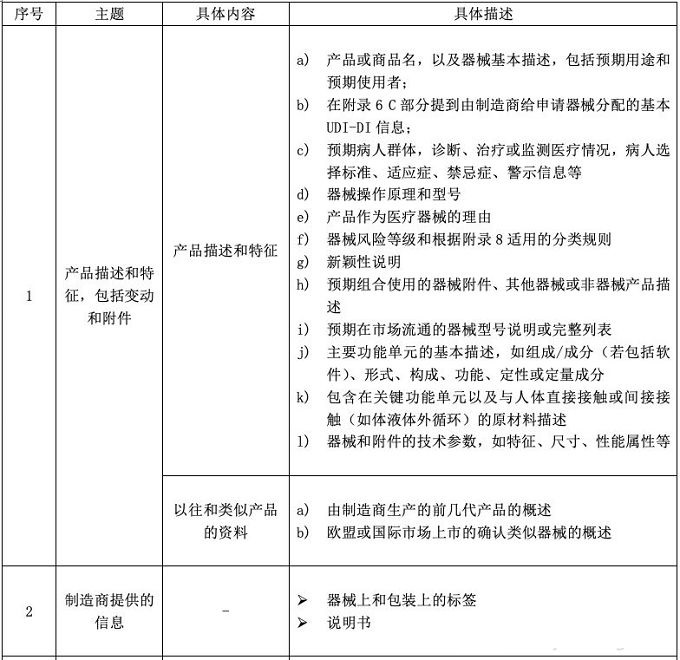
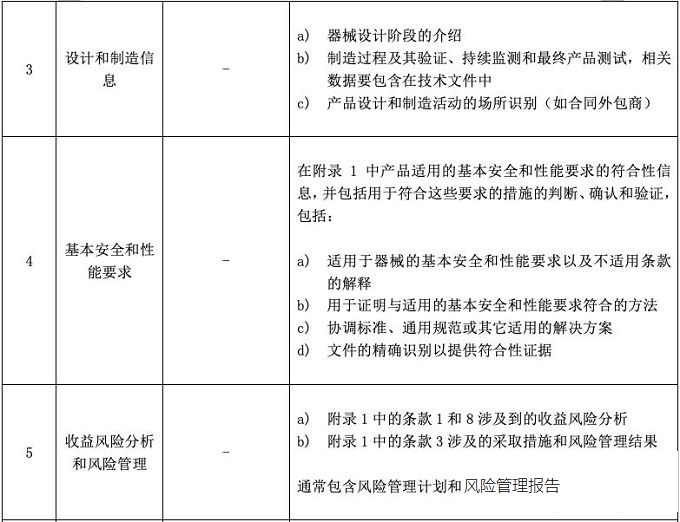
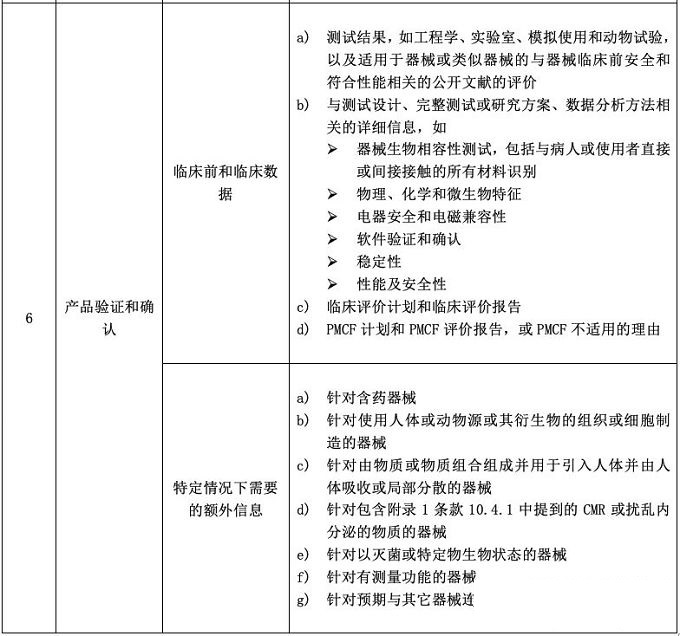
標(biāo)簽:醫(yī)療器械CE認證、醫(yī)療器械注冊