2021年10月13日����,藥監(jiān)總局發(fā)布關(guān)于公開征求《基因測序儀臨床評價注冊審查指導(dǎo)原則(征求意見稿)》意見的通知��,基因測序儀產(chǎn)品的醫(yī)療器械注冊審評及臨床評價相關(guān)事項就面向公眾公開征求意見�����。
2021年10月13日����,藥監(jiān)總局發(fā)布關(guān)于公開征求《基因測序儀臨床評價注冊審查指導(dǎo)原則(征求意見稿)》意見的通知,基因測序儀產(chǎn)品的醫(yī)療器械注冊審評及臨床評價相關(guān)事項就面向公眾公開征求意見����。

基因測序儀臨床評價注冊審查指導(dǎo)原則
(征求意見稿)
本指導(dǎo)原則旨在指導(dǎo)注冊申請人對基因測序儀注冊申報資料的準(zhǔn)備及撰寫,同時也為技術(shù)審評部門審評注冊申報資料提供參考�����。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則�����。
本指導(dǎo)原則是對基因測序儀的一般要求,申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用�。若不適用,需具體闡述理由并提供相應(yīng)的科學(xué)依據(jù)��,同時依據(jù)產(chǎn)品的具體特性對注冊申報資料的內(nèi)容進(jìn)行充實和細(xì)化�����。
本指導(dǎo)原則是在現(xiàn)行法規(guī)��、標(biāo)準(zhǔn)體系和當(dāng)前科學(xué)認(rèn)知水平下制定的�����,隨著法規(guī)��、標(biāo)準(zhǔn)體系的不斷完善和科學(xué)技術(shù)的不斷發(fā)展����,本指導(dǎo)原則相關(guān)內(nèi)容也將適時進(jìn)行調(diào)整���。
一���、適用范圍
本指導(dǎo)原則適用于高通量測序的基因測序儀采用通過同品種醫(yī)療器械臨床試驗或臨床使用獲得的數(shù)據(jù)或通過自身臨床試驗數(shù)據(jù)進(jìn)行臨床評價�����。
目前高通量基因測序技術(shù)即指第二代測序技術(shù)或下一代測序(Next Generation Sequencing 或NGS)技術(shù)�,其技術(shù)特征是:(1)通過測定單元的高度并行化來實現(xiàn)高通量(如每次運行獲得數(shù)百Mb及Gb序列)�;(2)由于化學(xué)、物理等原理的限制���,序列讀長較短����,一般在150~200bp(個別原理可以實現(xiàn)600bp��,比如焦磷酸測序法)����;(3)核心技術(shù)成熟。使用的元件(比如Flow Cell��、硅基陣列��、微流控電導(dǎo)結(jié)構(gòu)等)的加工技術(shù)(一般在微米尺度以上)技術(shù)成熟����,器件結(jié)構(gòu)和性能不具有挑戰(zhàn)性���。其主流平臺包括:(1)DNA聚合酶循環(huán)測序法(單色或多色熒光底物標(biāo)記);(2)DNA連接酶循環(huán)測序法(單色或多色熒光底物標(biāo)記)��;(3)焦磷酸循環(huán)測序法(原理一:單色或多色底物熒光���;原理二:電學(xué)傳感器)���?��;谄渌夹g(shù)的基因測序儀產(chǎn)品����,可參照本指導(dǎo)原則相關(guān)適用條款并結(jié)合產(chǎn)品特點準(zhǔn)備注冊申報資料�����。
本指導(dǎo)原則適用于申請產(chǎn)品注冊和相關(guān)許可事項變更的產(chǎn)品�。
申請人應(yīng)當(dāng)按照《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》的要求提交臨床評價資料,選擇通過同品種醫(yī)療器械臨床試驗或臨床使用獲得的數(shù)據(jù)進(jìn)行分析評價�����,或者臨床試驗這兩種評價路徑中適用的任一方式,提交相應(yīng)的臨床評價資料����。
二、通過同品種醫(yī)療器械臨床試驗或臨床使用獲得的數(shù)據(jù)進(jìn)行分析評價要求
(一)同品種基因測序儀判定
注冊申請人可按照通則中“同品種醫(yī)療器械”的定義和判定��,選擇對比產(chǎn)品�,并根據(jù)產(chǎn)品特征選擇合適的對比項目,基于詳實的研究結(jié)果�����,分析擬申報產(chǎn)品和同品種產(chǎn)品是否存在差異��。
申請人所選取的同品種基因測序儀����,其與擬申報產(chǎn)品工作原理相同、關(guān)鍵模塊相同����,其數(shù)據(jù)質(zhì)量(包含所測序列中每個堿基的準(zhǔn)確度:一般為儀器或分析軟件系統(tǒng)的堿基判定時特有的質(zhì)量值(quality score))、一次運行(run)的數(shù)據(jù)產(chǎn)量(包括平均產(chǎn)量���、最大產(chǎn)量���、產(chǎn)量在質(zhì)量Q值在不同質(zhì)量閾值下的平均產(chǎn)量等)��、測序在一定質(zhì)量閾值下的平均讀長(可包括高質(zhì)量的最長讀長和最短可用讀長等)��、儀器指定的不同測序模式��、不同測序模式產(chǎn)生的數(shù)據(jù)量和運行時間差異等關(guān)鍵指標(biāo)���,不應(yīng)顯著差異于擬申報產(chǎn)品。
對比項目包括但不限于附件1所列舉的項目�。對比內(nèi)容包括定性和定量數(shù)據(jù)��、驗證和確認(rèn)結(jié)果�,應(yīng)詳述二者的相同性和差異性,對差異性是否對產(chǎn)品的安全有效性產(chǎn)生不利影響�����,應(yīng)通過擬申報產(chǎn)品自身的數(shù)據(jù)進(jìn)行驗證和/或確認(rèn)�。對于相同性,也應(yīng)提交充分的證據(jù)��。
(二)擬申報產(chǎn)品與對比產(chǎn)品的評價關(guān)系
根據(jù)《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》中規(guī)定的評價路徑可知,擬申報產(chǎn)品與對比產(chǎn)品關(guān)系有兩種��,或為同品種產(chǎn)品���,或為非同品種產(chǎn)品��,如為同品種產(chǎn)品�,還需對兩者之間的差異是否對產(chǎn)品安全性�、有效性產(chǎn)生不利影響進(jìn)行進(jìn)一步評價。
針對擬申報產(chǎn)品與對比產(chǎn)品的差異���,注冊申請人需分析差異性是否對產(chǎn)品的安全性和有效性產(chǎn)生不利影響��,將擬申報產(chǎn)品自身的數(shù)據(jù)作為支持性資料��,如申報產(chǎn)品的非臨床研究數(shù)據(jù)�、臨床文獻(xiàn)數(shù)據(jù)����、臨床經(jīng)驗數(shù)據(jù)、針對差異性的臨床試驗數(shù)據(jù)等����。注冊申請人還需進(jìn)一步評價差異是否影響性能參數(shù)���,以及影響的程度和范圍,必要時提供臨床試驗數(shù)據(jù)進(jìn)行確認(rèn)���。
針對申報產(chǎn)品的生化原理(包括但不限于酶學(xué)反應(yīng)�����、信號發(fā)生����、信號源強(qiáng)度等)����、物理原理(包括但不限于信號采集部件、光源�、濾光器件等)、堿基質(zhì)量判斷軟件(包括但不限于堿基判斷算法���、核心數(shù)據(jù)集、錯誤率評估�、系統(tǒng)弱點評估等)、系統(tǒng)集成原理和性能(包括但不限于:系統(tǒng)結(jié)構(gòu)、核心模塊��、系統(tǒng)操控軟件�、操控人需求、可靠性等)等基本性能等通過功能測試過程與同品種產(chǎn)品進(jìn)行對比�����。
與同品種產(chǎn)品相比�,申報產(chǎn)品的性能指標(biāo)、數(shù)據(jù)質(zhì)量不低于對比產(chǎn)品時�����,可認(rèn)為申報產(chǎn)品基本符合同品種產(chǎn)品預(yù)期的臨床應(yīng)用要求����;若申報產(chǎn)品的關(guān)鍵模塊、產(chǎn)品結(jié)構(gòu)�����、主要功能等與同品種產(chǎn)品具有顯著差異��,且該差異影響申報產(chǎn)品的性能指標(biāo)���,尤其是影響數(shù)據(jù)質(zhì)量時�����,注冊申請人還需開展對應(yīng)差異的臨床試驗��,對申報產(chǎn)品性能是否滿足臨床使用需要進(jìn)行確認(rèn)���。
不同情形評價關(guān)系所需提交的支持性資料不盡相同����,具體內(nèi)容見表1�,表1給出的具體情況舉例可能不能涵蓋所有情況,申請人應(yīng)根據(jù)擬申報產(chǎn)品的具體情況進(jìn)行列舉和判定��,并給出判定的具體理由�����。
表1 擬申報產(chǎn)品與對比產(chǎn)品關(guān)系及需提交資料類型表
擬申報產(chǎn)品與對比產(chǎn)品關(guān)系 | 擬申報產(chǎn)品與對比產(chǎn)品差異類型 | 具體情況舉例 | 需提交 資料類型 |
屬于同品種(差異評價路徑可參考附件3) | 通常提交非臨床研究可能充分證明的差異 | 1.擬申報產(chǎn)品適用范圍不超出對比產(chǎn)品�。 2.擬申報產(chǎn)品芯片密度與對比產(chǎn)品相當(dāng),僅數(shù)量不一致����,后期信號數(shù)據(jù)處理基本一致。 3.擬申報產(chǎn)品流動槽支架的性能與對比產(chǎn)品不一致���。 4.擬申報產(chǎn)品流體自動化模塊的性能與對比產(chǎn)品不一致����。 5.擬申報產(chǎn)品緩沖劑吸管裝置的性能與對比產(chǎn)品不一致����。 以上差異未造成性能差異和數(shù)據(jù)質(zhì)量下降。 | 通常提交非臨床研究可能充分證明的差異:非臨床研究�����、和/或臨床文獻(xiàn)數(shù)據(jù)����、和/或臨床經(jīng)驗數(shù)據(jù) |
需要提交臨床試驗資料的差異 | 1.擬申報產(chǎn)品適用范圍多于對比產(chǎn)品。 2.擬申報產(chǎn)品軟件組件的主要功能��、核心算法(信號采集�、信號建模、信號糾錯等)與對比產(chǎn)品不一致�����。 3.擬申報產(chǎn)品芯片設(shè)計構(gòu)架、密度及后期信號數(shù)據(jù)處理等關(guān)鍵功能有較大差異�。 | 針對差異的臨床試驗資料 |
不屬于同品種 |
| 1.擬申報產(chǎn)品的工作原理與對比產(chǎn)品不相同。 2.擬申報產(chǎn)品的檢測原理和判讀方法與對比產(chǎn)品不相同�。 3.擬申報產(chǎn)品的使用環(huán)境與對比產(chǎn)品不相同。如臺式���、便攜式與落地式�����。 4.擬申報產(chǎn)品關(guān)鍵模塊的原理與對比產(chǎn)品不一致����。如成像模塊的原理不一致��。 5.擬申報產(chǎn)品的性能與對比產(chǎn)品差異較大�����。 | 重新選擇同品種產(chǎn)品進(jìn)行比較或補(bǔ)充針對產(chǎn)品的臨床試驗資料 |
(三)證明差異對產(chǎn)品的安全性�、有效性未產(chǎn)生不利影響的支持性資料(臨床經(jīng)驗數(shù)據(jù)、臨床文獻(xiàn)數(shù)據(jù)��、非臨床研究等)
支持性資料中應(yīng)明確說明擬申報產(chǎn)品與同品種基因測序儀的差異�;詳細(xì)說明針對擬申報產(chǎn)品與同品種基因測序儀的差異進(jìn)行的研究方式及研究結(jié)果���,提供的研究證據(jù)應(yīng)證明擬申報產(chǎn)品與同品種基因測序儀的差異對產(chǎn)品臨床使用的安全性和有效性帶來的收益/影響�����。
1.申請人應(yīng)當(dāng)完整地列出擬申報產(chǎn)品與同品種基因測序儀的所有差異點�,并說明這些差異點的相互關(guān)系。若不同差異點之間存在相關(guān)性或相互影響�����,則應(yīng)提供單個差異點影響的研究證據(jù)和關(guān)聯(lián)性差異點共存時影響的研究證據(jù)��。
2.申請人應(yīng)當(dāng)根據(jù)擬申報產(chǎn)品與同品種基因測序儀的具體差異點提供相應(yīng)的支持性資料���,資料的類型和數(shù)量應(yīng)根據(jù)擬申報產(chǎn)品和對比產(chǎn)品的差異點對產(chǎn)品安全性����、有效性的影響進(jìn)行確定����。
(四)針對差異性的非臨床研究資料
根據(jù)擬申報產(chǎn)品與同品種產(chǎn)品的差異性分析,申請人應(yīng)當(dāng)對擬申報產(chǎn)品與對比產(chǎn)品的差異性及各差異點對產(chǎn)品安全性和有效性的影響進(jìn)行全面評估���,針對差異分別列出所進(jìn)行的非臨床研究的內(nèi)容和結(jié)果�,包括但不僅限內(nèi)部研究資料或驗證報告等。
基于擬申報產(chǎn)品和同品種基因測序儀的對比結(jié)果����,如果非臨床研究、臨床文獻(xiàn)數(shù)據(jù)�����、臨床經(jīng)驗數(shù)據(jù)等無法充分地證明該差異對產(chǎn)品安全性和有效性的影響���,則申請人應(yīng)提供相應(yīng)的臨床試驗資料�。
(五)針對適用范圍項目的對比�,應(yīng)提供的臨床數(shù)據(jù)
針對適用范圍項目的對比,相同點應(yīng)提交同品種產(chǎn)品的臨床數(shù)據(jù)以及申報產(chǎn)品的非臨床數(shù)據(jù)作為支持性資料��,對于較同品種產(chǎn)品增加的適用范圍�,應(yīng)提交申報產(chǎn)品的臨床試驗數(shù)據(jù),同時可提交其他支持性資料��。
支持性資料為臨床文獻(xiàn)數(shù)據(jù)時��,申請人應(yīng)根據(jù)擬申報產(chǎn)品與同品種產(chǎn)品的差異點�,合理選擇臨床文獻(xiàn)數(shù)據(jù)庫����,準(zhǔn)確設(shè)置檢索詞�,進(jìn)行全面的科學(xué)文獻(xiàn)檢索,完成文獻(xiàn)檢索和篩選方案��、文獻(xiàn)檢索和篩選報告�����。
支持性資料為臨床經(jīng)驗數(shù)據(jù)時����,在綜合考慮����、科學(xué)分析擬申報產(chǎn)品與同品種產(chǎn)品差異的基礎(chǔ)上,可提供臨床經(jīng)驗數(shù)據(jù)收集內(nèi)容����,包括對已完成的臨床試驗、不良事件�����、與臨床風(fēng)險相關(guān)的糾正措施等數(shù)據(jù)的收集。
臨床文獻(xiàn)和經(jīng)驗數(shù)據(jù)的支持性資料應(yīng)重點分析適用范圍項目的對比�。其中可應(yīng)用于臨床項目應(yīng)考慮選擇不同變異類型、不同核酸類型的檢測項目�����。并充分分析項目中的數(shù)據(jù)質(zhì)量���。對于數(shù)據(jù)質(zhì)量進(jìn)行比較和充分評價�����。
支持性資料�����、同品種醫(yī)療器械臨床使用獲得的數(shù)據(jù)的收集���、同品種醫(yī)療器械臨床數(shù)據(jù)分析評價方法、臨床評價報告撰寫等方面的具體內(nèi)容可參照《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》的相關(guān)規(guī)定����。
三、臨床試驗路徑
臨床試驗的開展、方案的制定以及報告的撰寫均應(yīng)符合相關(guān)法規(guī)及《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》的要求�,如相關(guān)法規(guī)、文件有更新��,臨床試驗應(yīng)符合更新后的要求��。下面僅說明該類產(chǎn)品臨床試驗中應(yīng)關(guān)注的重點問題�。
(一)臨床試驗機(jī)構(gòu)
應(yīng)選擇不少于兩家(含兩家)符合要求的臨床試驗機(jī)構(gòu)開展臨床試驗。臨床試驗機(jī)構(gòu)應(yīng)具備相應(yīng)的檢測資質(zhì)和人員����。
(二)臨床試驗?zāi)康募霸O(shè)計
1. 臨床試驗?zāi)康?/p>
證明申報產(chǎn)品與已上市同類產(chǎn)品臨床性能的一致性。
2.對比方法的選擇
對于已有同類產(chǎn)品上市的臨床研究����,可以選擇臨床參考方法或已在中國境內(nèi)上市的同類產(chǎn)品作為對照����。如選同類產(chǎn)品作為對照,建議選擇目前在臨床檢測方面使用狀況良好的機(jī)型���,應(yīng)注意申報產(chǎn)品的適用范圍不應(yīng)超過同類產(chǎn)品的適用范圍���,同時應(yīng)提供對照產(chǎn)品的信息,如生產(chǎn)企業(yè)、型號���、適用范圍等��。如申報產(chǎn)品的適用范圍超過已批準(zhǔn)上市同類產(chǎn)品�,則可與同類產(chǎn)品作為對照對相同的適用范圍進(jìn)行評價���,并應(yīng)另外選擇臨床參考方法作為對比方法���,對超出同類產(chǎn)品的適用范圍進(jìn)行臨床評價。
對于無同類已上市產(chǎn)品的臨床研究�����,可選擇臨床參考方法作為對比方法進(jìn)行比較研究�����,以評價申報產(chǎn)品的臨床性能���。
臨床試驗中還應(yīng)對申報產(chǎn)品和對照產(chǎn)品/方法檢測結(jié)果不一致樣本進(jìn)行分析���,以明確結(jié)果不一致的原因��。
臨床參考方法可委托第三方機(jī)構(gòu)檢測����,但應(yīng)在臨床試驗方案中予以明確����。
3.驗證項目的選擇
應(yīng)根據(jù)申報產(chǎn)品所聲稱的適用范圍,選擇代表性的檢測項目進(jìn)行臨床評價��,同時應(yīng)考慮到不同樣本類型�。
如申報產(chǎn)品的適用范圍為對來源于人體樣本的人脫氧核糖核酸(DNA)進(jìn)行測序,以檢測基因序列變化�����。至少應(yīng)選擇人類基因靶向測序以及非靶向測序項目進(jìn)行評價���。其中人類基因靶向測序,建議選擇腫瘤組織的基因突變?yōu)閷ο?��,?yīng)包括代表性的突變類型���,如點突變、小片段的插入/缺失、拷貝數(shù)變化���。如適用范圍還包括核糖核酸(RNA)的測序���,即將RNA逆轉(zhuǎn)錄成DNA后進(jìn)行測序,則還應(yīng)對基因融合(如ALK融合)進(jìn)行驗證����。
如申報產(chǎn)品的適用范圍不限于人DNA,則應(yīng)增加病原體檢測項目����,不建議采用宏基因組測序的方式進(jìn)行臨床試驗。病原體應(yīng)來自于人體樣本��,包括病毒���、細(xì)菌�、真菌等��,每種類別各選一種代表性項目進(jìn)行評價���。如同時包括RNA���,則還應(yīng)選擇至少一種RNA病原體進(jìn)行評價�����。
應(yīng)根據(jù)臨床試驗中所選擇的臨床項目����,制定受試者的選擇標(biāo)準(zhǔn)�����,即入選和排除標(biāo)準(zhǔn)�����。同時受試者年齡�、性別分布應(yīng)均衡合理,充分考慮人種�、地域差異對試驗結(jié)果的影響。
4. 臨床評價指標(biāo)
主要評價指標(biāo)一般為檢測準(zhǔn)確性(靈敏度�、特異度)或檢測一致性(陽性/陰性符合率����、總符合率�、Kappa值等)��,主要評價指標(biāo)應(yīng)能夠滿足評價產(chǎn)品臨床性能的要求�����。
次要評價指標(biāo)一般包括儀器功能�����、穩(wěn)定性��、使用便捷性��、使用安全性等�。
同時申請人還應(yīng)對臨床試驗檢測項目進(jìn)行數(shù)據(jù)質(zhì)量的分析。
5.樣本量估算
為實現(xiàn)樣本代替總體的目的���,臨床試驗需要一定的受試者數(shù)量(樣本量)��。樣本量一般以臨床試驗的主要評價指標(biāo)進(jìn)行估算���。需在臨床試驗方案中說明樣本量估算的相關(guān)要素及其確定依據(jù)、樣本量的具體計算方法�����。主要評價指標(biāo)的相關(guān)參數(shù)根據(jù)已有臨床數(shù)據(jù)和小樣本可行性試驗(如有)的結(jié)果來估算,需要在臨床試驗方案中明確這些估計值的確定依據(jù)�。一般情況下,Ⅰ類錯誤概率α設(shè)定為雙側(cè)0.05或單側(cè)0.025�����,Ⅱ類錯誤概率β設(shè)定為不大于0.2�����,預(yù)期受試者脫落和方案違背的比例不大于0.2���,申請人可根據(jù)產(chǎn)品特征和試驗設(shè)計的具體情形采用不同的取值�,需充分論證其合理性��。
如臨床試驗采用申報產(chǎn)品與已上市同類產(chǎn)品進(jìn)行比較研究的試驗設(shè)計��,建議采用單組目標(biāo)值法樣本量公式估算最低樣本量�。
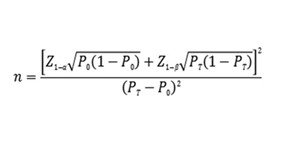
公式中,n為樣本量����;Z1-α、Z1-β為顯著性水平和把握度的標(biāo)準(zhǔn)正態(tài)分布的分?jǐn)?shù)位�,P0為評價指標(biāo)的臨床可接受標(biāo)準(zhǔn),PT為試驗用體外診斷試劑評價指標(biāo)預(yù)期值�����。
對于所選擇進(jìn)行臨床驗證的代表性項目大類��,如人類基因靶向測序�,總樣本量應(yīng)滿足統(tǒng)計學(xué)要求,其中每種代表性的突變類型均應(yīng)有一定例數(shù)�。
臨床試驗中如采用多中心臨床,則所有中心臨床樣本總數(shù)應(yīng)滿足統(tǒng)計學(xué)要求��,如采用非多中心臨床���,則每家臨床機(jī)構(gòu)樣本量應(yīng)均滿足統(tǒng)計學(xué)要求�。
6.統(tǒng)計分析
應(yīng)選擇合適的統(tǒng)計方法對臨床試驗結(jié)果進(jìn)行統(tǒng)計分析����,對于申報產(chǎn)品與參考方法/已上市同類產(chǎn)品的一致性評價,一般選擇2×2表的形式總結(jié)兩種產(chǎn)品的檢測結(jié)果����,并據(jù)此計算靈敏度/特異度��、陽性/陰性符合率���、Kappa值等指標(biāo)及其95%置信區(qū)間。
對于不一致樣本����,應(yīng)進(jìn)行原因分析。如臨床試驗方案規(guī)定采用其他方法進(jìn)行確認(rèn)����,則確認(rèn)結(jié)果不應(yīng)納入統(tǒng)計分析。
(三)質(zhì)量控制
臨床試驗開始前��,建議進(jìn)行臨床試驗的預(yù)試驗�����,以熟悉并掌握相關(guān)試驗方法的操作��、儀器��、技術(shù)性能等����,最大限度控制試驗誤差����。整個試驗過程都應(yīng)處于有效的質(zhì)量控制下����,最大限度保證試驗數(shù)據(jù)的準(zhǔn)確性及可重復(fù)性�����。
五���、決策是否開展醫(yī)療器械臨床試驗
對于具有下列情形之一的產(chǎn)品�,通過同品種醫(yī)療器械臨床試驗或臨床使用獲得的數(shù)據(jù)進(jìn)行分析評價無法充分證明產(chǎn)品安全性���、有效性的����,應(yīng)當(dāng)進(jìn)行臨床試驗��,包括:
1.擬申報產(chǎn)品或擬申報產(chǎn)品的某關(guān)鍵模塊(含軟件)具有全新的技術(shù)特性�����,或者數(shù)據(jù)質(zhì)量具有顯著差異。
2.擬申報產(chǎn)品具有新的臨床預(yù)期使用場景和功能�,且該功能從未在境內(nèi)獲得批準(zhǔn)。
3.針對與同品種醫(yī)療器械之間的差異��,若不能通過非臨床研究數(shù)據(jù)����、臨床應(yīng)用數(shù)據(jù)等證據(jù)資料證明申報產(chǎn)品的安全性和有效性,申請人需要考慮通過臨床試驗來獲得臨床數(shù)據(jù)�����。
具體決策是否開展醫(yī)療器械臨床試驗可參照附件2和附件3�����,并提供充分的依據(jù)���。
六�����、參考文獻(xiàn)
[1]《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》(2015年第14號通告)
[2] YY/T 1723-2020《高通量基因測序儀》[S]
七��、起草單位
起草單位:國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心
附件:1. 擬申報產(chǎn)品與同品種基因測序儀對比表
2. 同品種比對路徑
3. 基因測序儀同品種比對差異評價路徑
附件1
擬申報產(chǎn)品與同品種基因測序儀對比表
1.基本原理
1.1擬申報產(chǎn)品和同品種產(chǎn)品的工作原理應(yīng)一致���。應(yīng)詳述核心結(jié)構(gòu)模塊和原理����,包括:樣本來源和處理(包括片段化��、定向擴(kuò)增��、定向捕獲或純化等)�����、生化原理(包括催化酶��、底物標(biāo)記����、熒光化學(xué)�����、試劑保存����、硅基表面處理等)��、物理原理(光學(xué)或電學(xué)模塊并行化���、信號采集、信號處理���、液路設(shè)計�、廢液收集處理等)��、堿基判斷和質(zhì)量評估原理(包括信號采集處理�����、質(zhì)量評估��、序列組裝等核心算法和軟件來源)等����。
1.2產(chǎn)品類型應(yīng)明確臺式、便攜式�、大型儀器。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
基本原理 | 1.1 | 工作原理 |
|
|
|
|
|
|
1.1.1 | 生化原理 |
|
|
|
|
|
|
1.1.2 | 物理原理 |
|
|
|
|
|
|
1.1.3 | 信號放大和采集原理 |
|
|
|
|
|
|
1.1.4 | 信號處理原理(信號建模��、轉(zhuǎn)換、糾錯) |
|
|
|
|
|
|
| 1.1.5 | 堿基識別和質(zhì)量評估原理 |
|
|
|
|
|
|
| 1.1.6 | 高通量�����、并行化原理 |
|
|
|
|
|
|
| 1.1.7 | 液路系統(tǒng) |
|
|
|
|
|
|
| 1.1.8 | 信號放大和采集原理 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
| 1.2 | 產(chǎn)品類型 |
|
|
|
|
|
|
2.結(jié)構(gòu)組成
2.1產(chǎn)品組成應(yīng)包括描述申報產(chǎn)品的所有結(jié)構(gòu)組成����。對成像模塊、流動槽支架���、流體自動化模塊�����、緩沖劑吸管裝置等功能模塊、主體模塊等核心結(jié)構(gòu)模塊進(jìn)行逐項詳細(xì)比對���。
2.2核心部件應(yīng)至少對加樣裝置����、恒溫反應(yīng)裝置����、芯片���、信號采集、檢測器及其原件技術(shù)要求進(jìn)行對比�。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
結(jié)構(gòu)組成 | 2.1 | 產(chǎn)品組成 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
2.2 | 核心部件 |
|
|
|
|
|
|
2.2.1 | 流體液路系統(tǒng) |
|
|
|
|
|
|
2.2.2 | 恒溫反應(yīng)裝置 |
|
|
|
|
|
|
| 2.2.3 | 芯片設(shè)計構(gòu)架 |
|
|
|
|
|
|
| 2.2.4 | 恒溫反應(yīng)裝置 |
|
|
|
|
|
|
| 2.2.5 | 信號采集處理裝置 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
3.性能要求
3.1性能參數(shù)應(yīng)包括 最大數(shù)據(jù)量/run*run,reads長度����,突變類型以及人與病原體的檢測性能,并對數(shù)據(jù)質(zhì)量進(jìn)行充分評價�。
3.2反應(yīng)模式及時間應(yīng)包括所有的反應(yīng)模式如PE150,PE250����,SE35等。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
性能要求 | 3.1 | 性能參數(shù) |
|
|
|
|
|
|
3.2 | 功能參數(shù) |
|
|
|
|
|
|
|
| 反應(yīng)模式及用時 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
4.軟件核心功能及算法
4.1對比產(chǎn)品的軟件核心功能及算法
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
軟件核心功能 | 4.1 | 運行控制 |
|
|
|
|
|
|
4.2 | 狀態(tài)監(jiān)控 |
|
|
|
|
|
|
| 4.3 | 堿基識別 |
|
|
|
|
|
|
| 4.4 | 數(shù)據(jù)質(zhì)控 |
|
|
|
|
|
|
| 4.5 | 結(jié)果判讀 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.適用范圍及預(yù)期用途
5.1樣本類型通常包括血清��、全血���、組織�、FFPE及其他含有人類以及各種病原體的核酸的樣本類型等����,可采用代表性樣本類型(根據(jù)樣本中基因組特征)。
5.2變異類型通常包括點突變��、插入缺少、結(jié)構(gòu)變異等變異類型�����。
5.3檢測的核酸樣本類型通常包括人類基因組DNA�����、細(xì)胞內(nèi)RNA���、細(xì)胞外循環(huán)DNA或RNA��,病原體DNA或RNA等��。所有各類不同來源的RNA均須逆轉(zhuǎn)錄成互補(bǔ)DNA后才能用于測序����。
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
適用范圍預(yù)期用途 | 5.1 | 預(yù)期用途 |
|
|
|
|
|
|
5.2 | 代表性樣本類型 |
|
|
|
|
|
|
5.3 | 可完成試驗項目 |
|
|
|
|
|
|
5.4 | 變異類型 |
|
|
|
|
|
|
5.5 | 檢測的核酸類型 |
|
|
|
|
|
|
5.6 | 使用環(huán)境 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.配套要求
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
|
|
配套要求 | 6.1 | 上機(jī)文庫質(zhì)量要求 |
|
|
|
|
|
|
6.2 | 樣本來源和處理(包括片段化���、定向擴(kuò)增、定向捕獲或純化等) |
|
|
|
|
|
|
| 6.3 | 配套使用的測序通用試劑要求 |
|
|
|
|
|
|
|
| ... |
|
|
|
|
|
|
7.安全性評價
安全性 評價 | 7.1 | 通用電氣安全 |
|
|
|
|
|
7.2 | 專用安全 |
|
|
|
|
|
| 7.3 | 網(wǎng)絡(luò)安全 |
|
|
|
|
|
8.其他
序號 | 對比項目 | 同品種產(chǎn)品 | 擬申報產(chǎn)品 | 差異性 | 支持性資料概述 | 備注 |
8 | 標(biāo)簽 |
|
|
|
|
|
9 | 產(chǎn)品說明書 |
|
|
|
|
|
10 | 禁忌癥 |
|
|
|
|
|
11 | 防范措施和警告 |
|
|
|
|
|
12 | 產(chǎn)品符合的國家/行業(yè)標(biāo)準(zhǔn) |
|
|
|
|
|
| ... |
|
|
|
|
|
以上所列出的內(nèi)容為擬申報產(chǎn)品與同品種基因測序儀對比需要具體考慮的事項�����,申請人可根據(jù)產(chǎn)品特點增加對比項目。