醫(yī)療器械注冊質(zhì)量管理體系是什么�?是YY/T0287idtISO13485嗎��?是醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范嗎���?聽過我講課的朋友們應(yīng)該都清楚���,醫(yī)療器械注冊質(zhì)量管理體系是YY/T0287與ISO13485,及法規(guī)要求、客戶要求��、產(chǎn)品特點(diǎn)和工藝特點(diǎn)等的融合�����。今天���,從另一個(gè)視角����,為大家介紹有關(guān)醫(yī)療器械注冊體系核查的其它方面知識.
醫(yī)療器械注冊質(zhì)量管理體系是什么�?是YY/T0287idtISO13485嗎?是醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范嗎����?聽過我講課的朋友們應(yīng)該都清楚,醫(yī)療器械注冊質(zhì)量管理體系是YY/T0287與ISO13485,及法規(guī)要求��、客戶要求�、產(chǎn)品特點(diǎn)和工藝特點(diǎn)等的融合。今天����,從另一個(gè)視角,為大家介紹有關(guān)醫(yī)療器械注冊體系核查的其它方面知識.

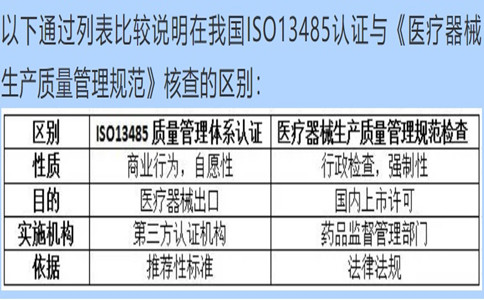
問:公司已經(jīng)通過了ISO13485的認(rèn)證和年度評估�,辦理醫(yī)療器械生產(chǎn)許可時(shí)藥監(jiān)局為什么還要來進(jìn)行生產(chǎn)質(zhì)量規(guī)范現(xiàn)場核查?
答:根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》規(guī)定�,第二類、第三類醫(yī)療器械生產(chǎn)新開辦�����、變更和延續(xù)均為行政許可事項(xiàng)�����,應(yīng)當(dāng)向所在地省、自治區(qū)���、直轄市人民政府藥品監(jiān)督管理部門申請生產(chǎn)許可����?�!夺t(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及附錄是醫(yī)療器械生產(chǎn)企業(yè)必須執(zhí)行的法規(guī)要求�,是獲得生產(chǎn)許可的基本條件。
ISO13485標(biāo)準(zhǔn)在國內(nèi)等同轉(zhuǎn)換為YY/T0287���,是醫(yī)療器械質(zhì)量管理體系推薦性行業(yè)標(biāo)準(zhǔn)�����,實(shí)施ISO13485認(rèn)證的第三方認(rèn)證機(jī)構(gòu)不具備行政許可資格�����,通過第三方認(rèn)證并不能作為上市許可的必要條件�。
問:質(zhì)量部門獨(dú)立行使權(quán)力在組織架構(gòu)上應(yīng)如何體現(xiàn)?有什么要求��?
答:按照《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的要求��,醫(yī)療器械生產(chǎn)企業(yè)應(yīng)建立質(zhì)量管理部門����,獨(dú)立行使職能�����,對產(chǎn)品質(zhì)量的相關(guān)事宜負(fù)有決策的權(quán)利�����。企業(yè)應(yīng)成立專門的��、獨(dú)立的質(zhì)量管理部門并由最高管理者或其授權(quán)代表直接管轄����。質(zhì)量管理部門應(yīng)包括QA及QC的職能,具體職能應(yīng)根據(jù)企業(yè)的實(shí)際情況在其職責(zé)文件中進(jìn)行明確規(guī)定��,例如質(zhì)量管理���、質(zhì)量控制����、質(zhì)量檢驗(yàn)、產(chǎn)品放行�、讓步接收、質(zhì)量審核��、質(zhì)量數(shù)據(jù)統(tǒng)計(jì)分析����、不合格品控制、內(nèi)部審核�����、管理評審等���。產(chǎn)品上市放行應(yīng)由質(zhì)量受權(quán)人負(fù)責(zé)����,質(zhì)量部門應(yīng)對產(chǎn)品質(zhì)量具有絕對的�、獨(dú)立的決策權(quán),確保每批次原料����、中間品���、終產(chǎn)品符合質(zhì)量要求。
任何有關(guān)醫(yī)療器械注冊質(zhì)量管理體系疑問���,歡迎您隨時(shí)方便與杭州證標(biāo)客聯(lián)絡(luò)�����。