上海是長三角經(jīng)濟帶最重要城市���,也是我國醫(yī)療器械注冊改革先發(fā)城市�����,在醫(yī)療器械監(jiān)管管理方面一直是榜樣和示范����。本文以上海市藥監(jiān)局發(fā)布的2011年度官方數(shù)據(jù)為基礎���,帶大家一起看醫(yī)療器械注冊質量管理體系考核常見不符合項���。
引言:上海是長三角經(jīng)濟帶最重要城市,也是我國醫(yī)療器械注冊改革先發(fā)城市,在醫(yī)療器械監(jiān)管管理方面一直是榜樣和示范�。本文以上海市藥監(jiān)局發(fā)布的2011年度官方數(shù)據(jù)為基礎,帶大家一起看醫(yī)療器械注冊質量管理體系考核常見不符合項�。
一、2021年度上海醫(yī)療器械注冊體系考核不合格項分布:
2021年度共完成現(xiàn)場核查909件����,累計發(fā)現(xiàn)不合項4648條,平均每次核查開具不合格項至少5條��。其中生產(chǎn)管理�����、質量控制����、設計開發(fā)、采購控制四部分的不合格項數(shù)量占總數(shù)的77%����。
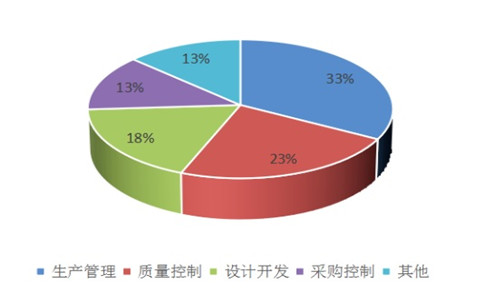
所有不符合項中,一般項不合格數(shù)量為3095條���,占比67%�,關鍵項(*星號項)不合格數(shù)量為1553條,占比為33%���,說明我市醫(yī)療器械生產(chǎn)質量管理體系運行能力和總體情況較好。在關鍵(*星號項)不合格項中�,生產(chǎn)管理占33%,質量控制占23%�����,設計開發(fā)占18%��,采購控制占13%���,這四部分合計占關鍵項總數(shù)的87%�����,進一步說明這四部分是醫(yī)療器械生產(chǎn)質量管理體系的核心和容易出現(xiàn)問題的薄弱點����。
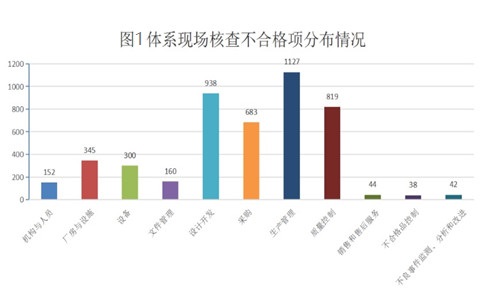
圖2.體系現(xiàn)場考核關鍵不符合項分布情況
從不同類別的產(chǎn)品不合格項數(shù)量分布的情況來看��,如下圖所示��,無菌產(chǎn)品共開具不合格項1527條,有源產(chǎn)品共開具不合格項1059條�,較其他類型產(chǎn)品顯著增加,一方面與無菌����、有源類產(chǎn)品申報數(shù)量相對較高有關,另一方面也說明有源產(chǎn)品部分生產(chǎn)企業(yè)質量管理體系基礎比較薄弱���,運行能力和有效性不足����;無菌類產(chǎn)品復雜�����,要求相對較高����,企業(yè)容易出現(xiàn)管控不到位的情況。
二�、醫(yī)療器械注冊質量體系核查發(fā)現(xiàn)的主要缺陷和風險:
(1)變更控制方面 在原材料供應商或質量標準、產(chǎn)品結構組成或性能指標�、生產(chǎn)方式或關鍵設備、工藝流程��、工藝參數(shù)、性能檢測方法或條件等方面發(fā)生變更后未及時進行風險評價�、驗證或確認、評審����,實質性變更未按法定程序申請變更注冊�;內部溝通缺乏,操作層面文件未同步更新等��,變更控制不充分�,可能導致上市后的違法風險、產(chǎn)品安全和有效風險�����。
(2)偏差控制方面 在產(chǎn)品實現(xiàn)過程中未能有效識別偏差����,物料質量等級或投料量、工藝配方和參數(shù)�、質量檢驗原始數(shù)據(jù)和方法等與質量標準、工藝文件��、產(chǎn)品技術要求等存在不一致的情況�,可能導致上市后的違法風險����、產(chǎn)品安全和有效風險���。
(3)可追溯性控制方面 未明確內部及外部可追溯范圍�����、途徑����、程度����,在原料、半成品或成品的批號/編號管理����、批記錄控制、設備使用管理���、倉庫出入庫管理�����、檢驗原始記錄管理等方面存在批號/編號未準確記錄����、批記錄關鍵參數(shù)不完整、關鍵設備記錄缺失����、出入庫信息不全、原始記錄不能提供��、銷售記錄不完整等問題��,不能實現(xiàn)產(chǎn)品質量有效追溯��。
(4)委托生產(chǎn)方面 存在委托生產(chǎn)質量協(xié)議不完整����、雙方職責分工不明確����、各過程接口不清晰、設計輸出文件轉移不全�����、受托方評審不充分、發(fā)生變更未及時溝通等問題����,可能導致產(chǎn)品質量安全風險。