經(jīng)導(dǎo)管二尖瓣夾產(chǎn)品在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品,在國(guó)家藥監(jiān)局公布的創(chuàng)新醫(yī)療器械時(shí)�����,有數(shù)個(gè)相關(guān)產(chǎn)品進(jìn)入創(chuàng)新醫(yī)療器械審批通道?�?紤]到產(chǎn)品的創(chuàng)新新�,多數(shù)醫(yī)療器械注冊(cè)人都是摸石頭過(guò)河,因此��,本文為大家介紹FDA已上市經(jīng)導(dǎo)管二尖瓣夾系統(tǒng)臨床評(píng)價(jià)情況�。
經(jīng)導(dǎo)管二尖瓣夾產(chǎn)品在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品,在國(guó)家藥監(jiān)局公布的創(chuàng)新醫(yī)療器械時(shí)�����,有數(shù)個(gè)相關(guān)產(chǎn)品進(jìn)入創(chuàng)新醫(yī)療器械審批通道�����??紤]到產(chǎn)品的創(chuàng)新新��,多數(shù)醫(yī)療器械注冊(cè)人都是摸石頭過(guò)河���,因此��,本文為大家介紹FDA已上市經(jīng)導(dǎo)管二尖瓣夾系統(tǒng)臨床評(píng)價(jià)情況���。
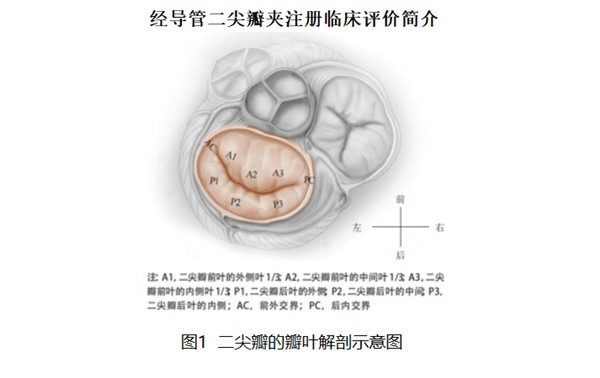
經(jīng)導(dǎo)管二尖瓣夾及可操控導(dǎo)引導(dǎo)管MitraClip System
MitraClip System是首個(gè)在FDA獲批的二尖瓣夾合器系統(tǒng)�,在開(kāi)展了EVEREST I Feasibility可行性研究后��,2005年開(kāi)始了EVEREST II RCT(以下簡(jiǎn)稱RCT)研究���。該臨床研究的對(duì)照組為外科手術(shù)�����,受試者為預(yù)期接受二尖瓣外科手術(shù)的人群�����。試驗(yàn)過(guò)程中�����,部分重度二尖瓣反流患者經(jīng)醫(yī)生判斷由于外科手術(shù)風(fēng)險(xiǎn)過(guò)高而無(wú)法入組RCT研究�,因此2007年該項(xiàng)目補(bǔ)充開(kāi)展了EVEREST II HRR(以下簡(jiǎn)稱HRR)單臂臨床研究���,并入組二尖瓣外科手術(shù)高風(fēng)險(xiǎn)人群��,RCT和HRR同步篩選受試者�。RCT和HRR完成入組后, Continued Access Registry REALISM于2009年啟動(dòng)���,該研究包含兩個(gè)隊(duì)列:外科手術(shù)高風(fēng)險(xiǎn)隊(duì)列(以下簡(jiǎn)稱HR)和非外科手術(shù)高風(fēng)險(xiǎn)隊(duì)列�����,該研究可供醫(yī)生和患者在MitraClip System注冊(cè)申報(bào)期間繼續(xù)使用該產(chǎn)品的同時(shí)��,申辦方也可繼續(xù)收集安全性和有效性數(shù)據(jù)�。
根據(jù)FDA公開(kāi)的審評(píng)信息��,盡管RCT研究證實(shí)MitraClip System可以被安全植入并降低大部分患者的二尖瓣反流��,但有效性不及外科手術(shù)(具體臨床試驗(yàn)結(jié)果見(jiàn)表1)����,因此該臨床研究不足以支持MitraClip System在手術(shù)候選人群中使用��。
圖1 EVEREST II RCT臨床試驗(yàn)結(jié)果總結(jié)
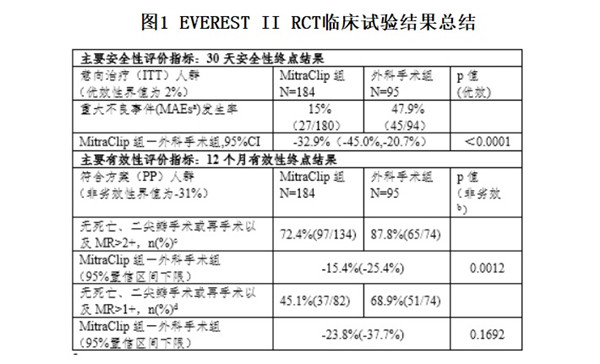
a. MAEs是包括死亡����、心肌梗死(MI)��、修復(fù)或置換手術(shù)失敗而導(dǎo)致的再手術(shù)��、不良事件導(dǎo)致的非計(jì)劃心血管手術(shù)�、中風(fēng)�����、腎功能衰竭��、深部創(chuàng)口感染�、連續(xù)48小時(shí)通氣、胃腸道(GI)并發(fā)癥導(dǎo)致的手術(shù)���、新發(fā)的持續(xù)性房顫�����、敗血癥以及輸注2個(gè)及以上單位的血液等臨床事件的復(fù)合指標(biāo)����。
b. 此處p值是基于非劣效界值為-31%計(jì)算出來(lái)的���,然而由于非劣效界值過(guò)大���,該結(jié)果不意味著存在非劣效性結(jié)論�����。
c. 申辦方雅培預(yù)設(shè)的終點(diǎn)
d. FDA預(yù)設(shè)的終點(diǎn)
申請(qǐng)人通過(guò)與FDA和臨床專家探討�����,MitraClip System在2011年4月縮窄了申報(bào)范圍���,只針對(duì)因外科手術(shù)風(fēng)險(xiǎn)過(guò)高而無(wú)法接受治療的退行性二尖瓣反流(Degenerative Mitral Regurgitation,DMR)和功能性二尖瓣反流(Functional Mitral Regurgitation���,F(xiàn)MR)患者���。HRR和REALISM HR(REALISM非外科手術(shù)高風(fēng)險(xiǎn)隊(duì)列于2011年9月暫停入組)兩個(gè)單臂臨床研究針對(duì)這部分人群開(kāi)展,但是存在局限性���,包括:二尖瓣反流病因的異質(zhì)性����、數(shù)據(jù)合并��、事后設(shè)置對(duì)照組(杜克大學(xué)醫(yī)學(xué)中心數(shù)據(jù)庫(kù)中65例外科手術(shù)高風(fēng)險(xiǎn)DMR患者)�、事后分析、數(shù)據(jù)可靠性以及難以定義受試者的手術(shù)風(fēng)險(xiǎn)����。
在2013年3月20日的專家咨詢會(huì)上,與會(huì)專家認(rèn)為EVEREST II HRR和REALISM HR研究中351名患者的臨床數(shù)據(jù)合理地證明了MitraClip System在外科手術(shù)高風(fēng)險(xiǎn)人群中的使用是安全的�����。然而�,由于上述的局限性,尤其是受試者手術(shù)風(fēng)險(xiǎn)定義和二尖瓣反流病因的異質(zhì)性��,大部分專家咨詢小組成員無(wú)法得出有效性的結(jié)論�。會(huì)后,F(xiàn)DA與申請(qǐng)人共同決定使用HRR和REALISM HR入組的外科手術(shù)高風(fēng)險(xiǎn)DMR患者來(lái)評(píng)價(jià)MitraClip System的風(fēng)險(xiǎn)受益�����,因?yàn)榻?jīng)導(dǎo)管二尖瓣緣對(duì)緣修復(fù)術(shù)對(duì)DMR患者減少二尖瓣反流的價(jià)值更為明確�。DMR是一種瓣膜出現(xiàn)的“機(jī)械故障”,目前尚無(wú)有效藥物手段來(lái)降低DMR導(dǎo)致的二尖瓣反流���,只能用“機(jī)械”的方法來(lái)矯正����。但對(duì)于FMR來(lái)說(shuō),最佳藥物治療有一定受益����,因?yàn)镕MR繼發(fā)于左心室功能障礙,而左心室功能障礙可以通過(guò)藥物治療�����、血運(yùn)重建和/或心臟再同步治療得到改善���。因此���,MitraClip System在FMR中的臨床受益無(wú)法通過(guò)現(xiàn)有的單臂研究結(jié)果來(lái)確定。
最終���,通過(guò)對(duì)EVEREST II��、HRR和REALISM中127例外科手術(shù)高風(fēng)險(xiǎn)DMR患者的臨床數(shù)據(jù)進(jìn)行分析����,F(xiàn)DA批準(zhǔn)了MitraClip System用于二尖瓣原發(fā)性異常(退行性二尖瓣反流)導(dǎo)致的顯著癥狀性二尖瓣反流(MR≥3+)病例,經(jīng)心臟團(tuán)隊(duì)確診�,存在二尖瓣手術(shù)高風(fēng)險(xiǎn)的患者�。
針對(duì)FMR,MitraClip System在2012年12月開(kāi)展了COAPT研究�,在美國(guó)和加拿大的78個(gè)中心招募了614名患有中重度或重度二尖瓣反流,并且在最大藥物治療劑量下仍有癥狀的心力衰竭患者�。受試者被隨機(jī)分至接受經(jīng)導(dǎo)管緣對(duì)緣修復(fù)術(shù)聯(lián)合指南導(dǎo)向藥物治療組(MitraClip System + GDMT)或僅接受指南導(dǎo)向藥物治療(GDMT)組。試驗(yàn)的主要有效性終點(diǎn)是兩年內(nèi)的心衰住院率�,主要安全性終點(diǎn)是12個(gè)月內(nèi)無(wú)器械相關(guān)安全性事件發(fā)生的概率?�;贑OAPT研究����,F(xiàn)DA批準(zhǔn)了MitraClip System用于使用最大劑量的指南導(dǎo)向藥物治療后仍有癥狀的中重度或重度繼發(fā)性二尖瓣反流患者。
如有第三類醫(yī)療器械注冊(cè)咨詢服務(wù)需求�,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工��,電話:18058734169��,微信同���。