醫(yī)用縫合針由GB/T 4240中規(guī)定的30Cr13、40Cr13�、12Cr18Ni9、06Cr19Ni10牌號不銹鋼材料制造,用于縫合內(nèi)臟��、軟組織�、皮膚等,無菌提供����,一次性使用。醫(yī)用縫合針在我國屬于第二類醫(yī)療器械注冊產(chǎn)品�,一起來了解醫(yī)用縫合針注冊要求。
醫(yī)用縫合針由GB/T 4240中規(guī)定的30Cr13���、40Cr13�����、12Cr18Ni9�、06Cr19Ni10牌號不銹鋼材料制造,用于縫合內(nèi)臟��、軟組織���、皮膚等���,無菌提供,一次性使用���。醫(yī)用縫合針在我國屬于第二類醫(yī)療器械注冊產(chǎn)品���,一起來了解醫(yī)用縫合針注冊要求。
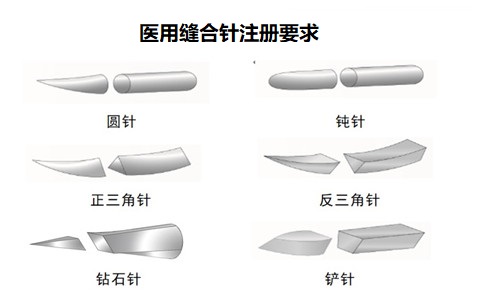
醫(yī)用縫合針注冊要求及審評要點:
1.醫(yī)用縫合針注冊單元的劃分
縫合針由針尖��、針體����、針尾組成(見圖1),該產(chǎn)品一般一次性使用����。根據(jù)《醫(yī)療器械分類目錄》,申報產(chǎn)品分類編碼為02-07-01���。醫(yī)用縫合針注冊單元應以產(chǎn)品的技術原理����、結構組成、性能指標和適用范圍為劃分依據(jù)�。
如:不同牌號不銹鋼材料制作的縫合針可劃至同一注冊單元。通過鋒利的針尖結構進行穿刺��、切割����,經(jīng)過針體的平滑過渡,引導縫合線進行縫合�。
2.產(chǎn)品技術要求
縫合針的基本技術性能指標主要參照YY/T 0043《醫(yī)用縫合針》。在此基礎上���,申請人應根據(jù)產(chǎn)品的特點制定保證產(chǎn)品安全有效��、質(zhì)量可控的技術要求�����,不適用部分應在研究資料中說明理由�。產(chǎn)品技術指標及試驗方法均應經(jīng)過驗證��。常見的技術指標包括但不限于以下內(nèi)容:
2.1外觀
2.1.1針體
2.1.2三角刃口
2.1.3表面粗糙度
2.1.4彈機孔嵌線(如適用)
2.2物理性能
2.2.1硬度
2.2.2彈性
2.2.3韌性
2.2.4針尖強度(弦長L≥12mm的縫合針適用)
2.3使用性能
2.3.1刺穿力
2.3.2切割力
2.4初始污染菌(如適用)
2.5耐腐蝕性能
2.6滅菌(如適用)
2.7環(huán)氧乙烷殘留(如適用)
3.生物相容性評價研究
應參照GB/T 16886.1《醫(yī)療器械生物學評價 第1部分:風險管理過程中的評價與試驗》對成品(主要考慮與患者和使用者直接或間接接觸的材料)的生物相容性進行評價��。生物相容性評價研究資料應當包括:生物相容性評價的依據(jù)和方法,產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)��,實施或豁免生物學試驗的理由和論證����,對于現(xiàn)有數(shù)據(jù)或試驗結果的評價���。
生物學評價過程中應當注重運用已有信息(包括材料���、文獻資料、體外和體內(nèi)試驗數(shù)據(jù)�����、臨床經(jīng)驗)�,當生物學評價確定需要進行生物學試驗時,應至少符合YY/T 0043以下要求:細胞毒性試驗反應不大于1級���;遲發(fā)型超敏反應應不大于1級���;皮內(nèi)反應計分應不大于1。
4.滅菌工藝研究
4.1生產(chǎn)企業(yè)滅菌:應明確滅菌工藝(方法和參數(shù))和無菌保證水平(SAL)�,并提供滅菌確認報告��。器械的滅菌應通過GB 18279.1�、GB/T 18279.2或GB 18280.1�、GB 18280.2、GB/T 18280.3確認并進行常規(guī)控制���,無菌保證水平(SAL)應保證達到1×10-6����。
4.2終端用戶滅菌:應當明確推薦的滅菌工藝(方法和參數(shù))及所推薦的滅菌方法確定的依據(jù)���。終端用戶滅菌的縫合針無菌保證水平(SAL)也應達到1×10-6���。
4.3殘留毒性:若滅菌使用的方法容易出現(xiàn)殘留,如采用環(huán)氧乙烷滅菌�����,應當明確殘留物信息及采取的處理方法��,并提供研究資料�,企業(yè)需提供保證產(chǎn)品出廠時環(huán)氧乙烷殘留量不得大于10μg/g的處理方法。
4.4微生物控制:通過控制生產(chǎn)環(huán)境和生產(chǎn)過程保證初始污染菌水平。若縫合針非滅菌提供�����,其初始污染菌應小于等于100 CFU/件���;且應當提供證明包裝能減少產(chǎn)品受到微生物污染的風險���,且適用于生產(chǎn)企業(yè)規(guī)定滅菌方法的研究資料���。
4.5滅菌過程的選擇應至少考慮以下因素:產(chǎn)品與滅菌過程間的適應性��;包裝材料與滅菌過程的適應性����、滅菌對產(chǎn)品安全有效性的影響等���。
5.產(chǎn)品貨架有效期和包裝研究
5.1貨架有效期包括產(chǎn)品有效期和包裝有效期�����。產(chǎn)品有效期驗證可采用實時老化或加速老化的研究����。加速老化試驗研究的具體要求可參考YY/T 0681.1,應遵循極限試驗等原則�����。在進行加速老化試驗研究時應注意:產(chǎn)品選擇的環(huán)境條件的老化機制應與宣稱的運輸儲存真實條件下發(fā)生產(chǎn)品老化的機制相匹配一致�。
對于包裝的有效期驗證,建議申請人提交在選擇恰當?shù)牟牧虾桶b結構合格后的最終成品包裝的初始完整性和維持完整性的檢測結果���。
5.2包裝及包裝完整性:在宣稱的有效期內(nèi)以及運輸儲存條件下��,保持包裝完整性的依據(jù)�。包裝材料的選擇應至少考慮以下因素:包裝材料的物理化學性能�����;包裝材料的毒理學特性��;包裝材料與產(chǎn)品的適應性�;包裝材料與成型和密封過程的適應性;包裝材料與滅菌過程的適應性����;包裝材料所能提供的物理、化學和微生物屏障保護;包裝材料與使用者使用時的要求(如無菌開啟)的適應性�����;包裝材料與標簽系統(tǒng)的適應性����;包裝材料與正常貯存運輸途徑和過程的適合性?��?蓞⒖?/span>GB/T 19633���、YY/T 0681系列標準等��。