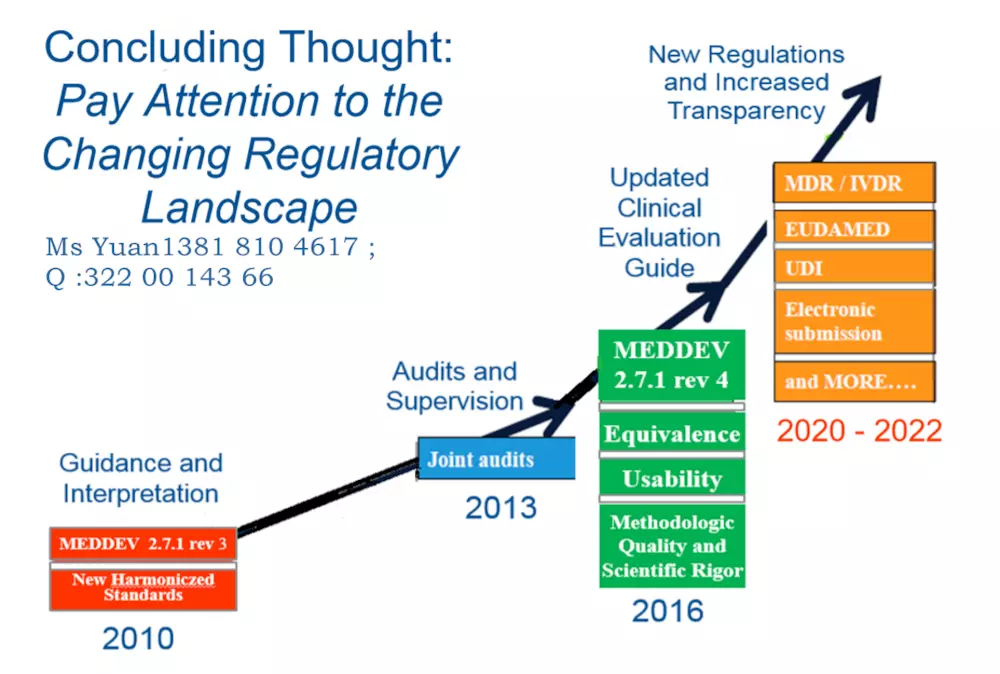
2017年5月,歐盟醫(yī)療器械新法規(guī)MDR (REGULATION EU 2017/745) 頒布�,新的法規(guī)將替代原有的醫(yī)療器械指令 (MDD 93/42/EEC) 和有源植入性醫(yī)療器械指令 (AIMDD 90/385/EEC) 。
2017年5月����,歐盟醫(yī)療器械新法規(guī)MDR (REGULATION EU 2017/745) 頒布,新的法規(guī)將替代原有的醫(yī)療器械指令 (MDD 93/42/EEC) 和有源植入性醫(yī)療器械指令 (AIMDD 90/385/EEC) ����。
從2020年5月開始公告機構不能按照MDD頒發(fā)CE證書�,目前 I*及以上風險等級產品認證機構已不再受理MDD指令的認證申請����。
對于目前獲得醫(yī)療器械CE認證證書的企業(yè),應基于自身設備的臨床證據(jù)的充分性合理安排申請MDR的時間��,盡快啟動MDR法規(guī)合規(guī)準備事宜���。
歐盟委員會規(guī)定了MDR 的轉換期的要求
2017年5 月25 日:MDR 和IVDR 生效
2020年3 月25 日:啟動歐盟醫(yī)療器械數(shù)據(jù)庫(Eudamed)
2020年5 月25 日:MDR 實施開始
2022年5 月25 日:IVDR 實施開始
2024年5 月25 日:AIMD����,MDD 和IVDD 證書將失效
我們該怎么辦����?
l 重新確認產品風險分類等級����,確認是否有風險等級升級的情況?
例如部分可重復使用的醫(yī)療器械�,原屬于ClassⅠ的器械,按照新法規(guī)變成了ClassⅠ*類器械���。美容類產品原MDD下不屬于醫(yī)療范圍����,現(xiàn)MDR法規(guī)中已納入;
l 確認原CE證書的發(fā)證機構是否已獲得歐盟當局批準的頒發(fā)MDR證書的資質����,目前擁有該資質的認證機構:BSI、TUV南德(注意TUV萊茵目前還未獲得批準)���;
l 確認原CE認證時的技術文件中是否含有按照Rev4指導原則提供的臨床評價報告���;
l 確定企業(yè)合規(guī)負責人(MDR法規(guī)要求),有相應能力�����、資質和經(jīng)驗來承擔相應的法規(guī)工作職責����。
l 修改原CE技術文件,建立質量管理體系����,向具有MDR發(fā)證資質的認證機構提出MDR-CE認證申請�,獲得MDR法規(guī)下的新CE證書����。