《醫(yī)療器械監(jiān)督管理條例》(國務(wù)院令第650號)第十條規(guī)定:向我國境內(nèi)出口第一類醫(yī)療器械的境外生產(chǎn)企業(yè),由其在我國境內(nèi)設(shè)立的代表機(jī)構(gòu)或者指定我國境內(nèi)的企業(yè)法人作為代理人�����,向國務(wù)院食品藥品監(jiān)督管理部門提交備案資料和備案人所在國(地區(qū))主管部門準(zhǔn)許該醫(yī)療器械上市銷售的證明文件���。備案資料載明的事項發(fā)生變化的���,應(yīng)當(dāng)向原備案部門變更備案。這是我國對進(jìn)口第一類醫(yī)療器械產(chǎn)品備案的法規(guī)要求��。
《醫(yī)療器械監(jiān)督管理條例》第十條規(guī)定:向我國境內(nèi)出口第一類醫(yī)療器械的境外生產(chǎn)企業(yè)��,由其在我國境內(nèi)設(shè)立的代表機(jī)構(gòu)或者指定我國境內(nèi)的企業(yè)法人作為代理人��,向國務(wù)院食品藥品監(jiān)督管理部門提交備案資料和備案人所在國(地區(qū))主管部門準(zhǔn)許該醫(yī)療器械上市銷售的證明文件��。備案資料載明的事項發(fā)生變化的�,應(yīng)當(dāng)向原備案部門變更備案����。這是我國對進(jìn)口第一類醫(yī)療器械產(chǎn)品備案的法規(guī)要求。
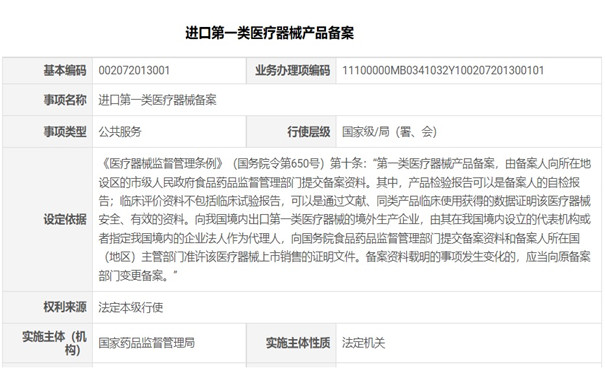
一、進(jìn)口第一類醫(yī)療器械產(chǎn)品備案流程說明:
備案人應(yīng)當(dāng)按照《國家食品藥品監(jiān)督管理總局關(guān)于第一類醫(yī)療器械備案有關(guān)事項的公告》(2014年第26號)的規(guī)定提交資料����。備案事項屬于本部門職權(quán)范圍,備案資料齊全���、符合形式要求的���,當(dāng)場予以備案,并提供備案人加蓋本部門專有印章的備案憑證�,將備案信息表中登載的信息在國家藥監(jiān)局網(wǎng)站上予以公布。備案資料不齊全或者不符合規(guī)定形式的�,應(yīng)當(dāng)一次告知需要補正的全部內(nèi)容,對不予備案的����,應(yīng)當(dāng)告知備案人并說明理由。
二�����、進(jìn)口第一類醫(yī)療器械產(chǎn)品備案材料:
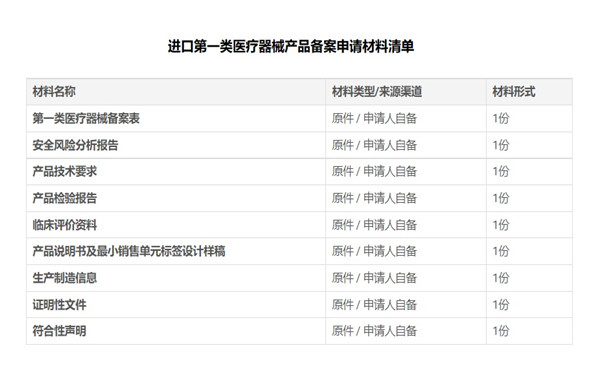
任何有關(guān)進(jìn)口第一類醫(yī)療器械產(chǎn)品備案需求�����,歡迎您隨時方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司葉工聯(lián)系,電話:18058734169��,微信同��。