2025年1月1日���,國家藥監(jiān)局發(fā)布《關(guān)于注冊申請表中體外診斷試劑分類編碼調(diào)整的有關(guān)事項通告(2024年第33號)》���,體外診斷試劑注冊申請表中試劑分類編碼調(diào)整成按照“6840-XX(一級序號)-XXXXX(二級序號)”格式填寫�,一起來看具體規(guī)定��。
2025年1月1日,國家藥監(jiān)局發(fā)布《關(guān)于注冊申請表中體外診斷試劑分類編碼調(diào)整的有關(guān)事項通告(2024年第33號)》��,體外診斷試劑注冊申請表中試劑分類編碼調(diào)整成按照“6840-XX(一級序號)-XXXXX(二級序號)”格式填寫����,一起來看具體規(guī)定。
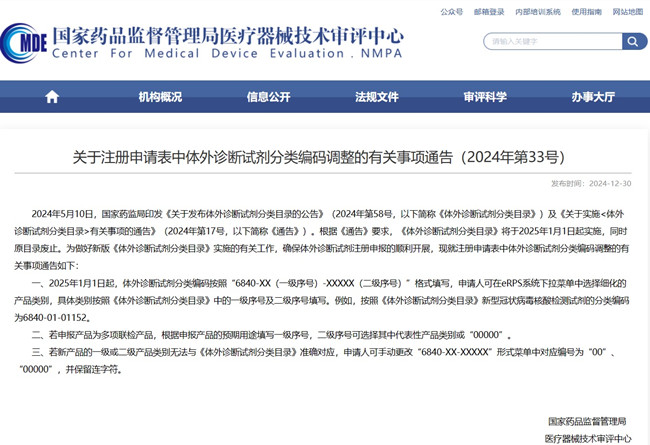
關(guān)于注冊申請表中體外診斷試劑分類編碼調(diào)整的有關(guān)事項通告(2024年第33號)
2024年5月10日����,國家藥監(jiān)局印發(fā)《關(guān)于發(fā)布體外診斷試劑分類目錄的公告》(2024年第58號,以下簡稱《體外診斷試劑分類目錄》)及《關(guān)于實施<體外診斷試劑分類目錄>有關(guān)事項的通告》(2024年第17號��,以下簡稱《通告》)�����。根據(jù)《通告》要求����,《體外診斷試劑分類目錄》將于2025年1月1日起實施,同時原目錄廢止����。為做好新版《體外診斷試劑分類目錄》實施的有關(guān)工作,確保體外診斷試劑注冊申報的順利開展�,現(xiàn)就注冊申請表中體外診斷試劑分類編碼調(diào)整的有關(guān)事項通告如下:
一����、2025年1月1日起�,體外診斷試劑分類編碼按照“6840-XX(一級序號)-XXXXX(二級序號)”格式填寫,申請人可在eRPS系統(tǒng)下拉菜單中選擇細化的產(chǎn)品類別�,具體類別按照《體外診斷試劑分類目錄》中的一級序號及二級序號填寫。例如�����,按照《體外診斷試劑分類目錄》新型冠狀病毒核酸檢測試劑的分類編碼為6840-01-01152����。
二、若申報產(chǎn)品為多項聯(lián)檢產(chǎn)品�,根據(jù)申報產(chǎn)品的預(yù)期用途填寫一級序號,二級序號可選擇其中代表性產(chǎn)品類別或“00000”���。
三����、若新產(chǎn)品的一級或二級產(chǎn)品類別無法與《體外診斷試劑分類目錄》準(zhǔn)確對應(yīng)���,申請人可手動更改“6840-XX-XXXXX”形式菜單中對應(yīng)編號為“00”�、“00000”��,并保留連字符�。