內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊(cè)流程和要求
發(fā)布日期:2020-08-04 18:04瀏覽次數(shù):3814次
內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊(cè)流程和要求��,詳見正文���。
引言:內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊(cè)流程和要求���,詳見正文��。

一���、內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊(cè)受理?xiàng)l件:
1.已在內(nèi)蒙古自治區(qū)轄區(qū)內(nèi)依法登記的企業(yè)。 2.已確定申報(bào)產(chǎn)品為第二類醫(yī)療器械����,申報(bào)注冊(cè)的產(chǎn)品已經(jīng)列入《醫(yī)療器械產(chǎn)品分類目錄》的第二類醫(yī)療器械或者國(guó)家總局界定文件中明確為第二類醫(yī)療器械的產(chǎn)品;對(duì)于新研制的尚未列入分類目錄的醫(yī)療器械����,經(jīng)國(guó)家總局確認(rèn)為二類醫(yī)療器械的產(chǎn)品。 3.已具備擬注冊(cè)產(chǎn)品的生產(chǎn)能力�����,按照醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范的相關(guān)要求建立與產(chǎn)品研制���、生產(chǎn)有關(guān)的質(zhì)量管理體系并保持有效運(yùn)行���; 申請(qǐng)注冊(cè)時(shí)樣品不得委托其他企業(yè)生產(chǎn),按照創(chuàng)新醫(yī)療器械特別審批程序?qū)徟漠a(chǎn)品除外�。 4.辦理醫(yī)療器械注冊(cè)申請(qǐng)的人員具有相應(yīng)的專業(yè)知識(shí),熟悉醫(yī)療器械注冊(cè)管理的法規(guī)、規(guī)章和有關(guān)的技術(shù)要求����。 5.申請(qǐng)人申請(qǐng)注冊(cè),應(yīng)當(dāng)遵循醫(yī)療器械安全有效基本要求�����,保證研制過程規(guī)范���,所有數(shù)據(jù)真實(shí)�����、完整�����、可溯源���。 6.申請(qǐng)注冊(cè)的資料應(yīng)當(dāng)使用中文����。根據(jù)外文資料翻譯的,應(yīng)當(dāng)同時(shí)提供原文。引用未公開發(fā)表的文獻(xiàn)資料時(shí)�,應(yīng)當(dāng)提供資料所有者許可使用的證明文件。申請(qǐng)人對(duì)資料的真實(shí)性負(fù)責(zé)�。 7.申報(bào)資料齊全,符合申報(bào)材料要求及相關(guān)法律法規(guī)的規(guī)定條件��。 8.對(duì)于國(guó)家食品藥品監(jiān)督管理總局已發(fā)布相應(yīng)產(chǎn)品注冊(cè)技術(shù)指導(dǎo)原則��,申請(qǐng)人應(yīng)參照?qǐng)?zhí)行��。
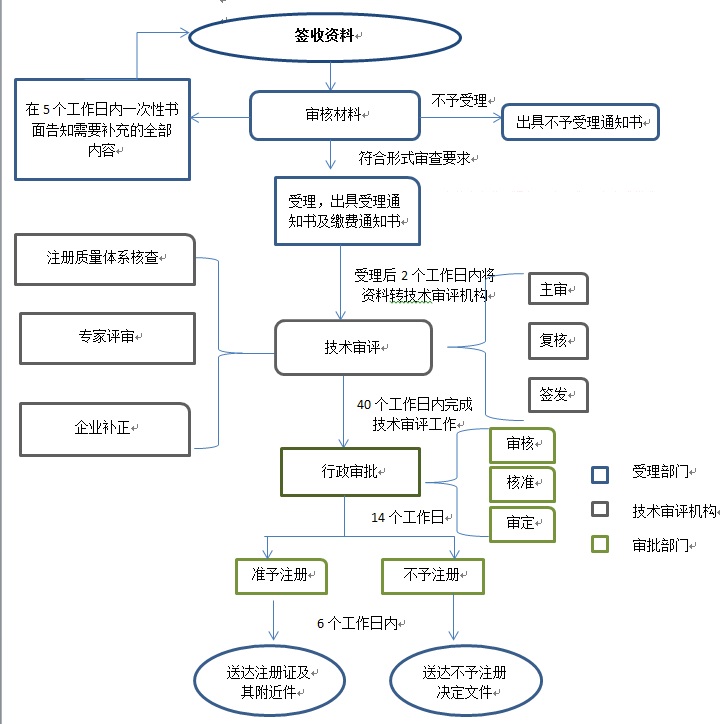
二�、內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊(cè)流程:
上一篇:沒有了
下一篇:沒有了